Nella moderna frutticoltura la fase di impianto rappresenta un momento di fondamentale importanza in quanto comporta scelte che influiranno per diversi anni sul rendimento quali-quantitativo degli investimenti effettuati e, quindi, sulla redditività dell’azienda. Una delle scelte tecniche strategiche all’impianto riguarda, senza dubbio, la varietà e, in particolare, la qualità genetico-sanitaria delle piante messe a dimora.
Controlli fitopatologici importanti per la redditività
La produzione di materiale vivaistico di elevata qualità rappresenta quindi il primo e fondamentale anello del processo produttivo frutticolo, poiché è in grado di condizionarne fortemente la futura redditività. Tutta la filiera vivaistica deve quindi operare al fine di azzerare l’incidenza di fitopatologie nel materiale poi venduto agli agricoltori. I vivaisti si impegnano con importanti investimenti nelle proprie aziende, contestualmente richiedono ai Centri di Conservazione quali il CAV di fornire loro materiale di “categoria base” avente il massimo delle garanzie sanitarie.
Quasi tutte le malattie sono oggi facilmente diagnosticabili, tuttavia alcuni patogeni potrebbero sfuggire alla maglia dei controlli, vuoi perché settoriali, cioè non presenti in tutti i settori/organi della pianta, vuoi perché latenti, ovvero presenti a concentrazioni bassissime e non sempre rilevabili con le attuali tecniche di diagnostica. Ogni anno i Centri di Conservazione ricevono dai vivaisti stessi e dai costitutori nuove varietà da introdurre nel processo di certificazione, le cosiddette “piante madri candidate di pre-base”.
Le analizzano per verificarne lo stato sanitario e la rispondenza genetica secondo i protocolli previsti dai più recenti disciplinari di certificazione genetico-sanitaria, processo che dura fino a 3-4 anni prima di emettere un responso sull’assenza di organismi nocivi agenti di malattie. Avere la certezza che queste piante siano sane è fondamentale, perché da queste piante madri partiranno tutte le successive fasi di moltiplicazione.


Digital Droplet Pcr
È da queste considerazioni che è nata la necessità di mettere a punto un sistema diagnostico innovativo in grado di garantire la sanità assoluta delle fonti candidate. La tecnica introdotta è la “Digital Droplet PCR” oggi usata in medicina umana per la diagnostica precoce di importanti virus, quali l’HIV, essendo la stessa capace di rilevare anche una sola copia del DNA/RNA virale nel campione testato. Nel nostro caso rileva la presenza del patogeno (es. virus, viroide, fitoplasma, batterio o nematode) nella pianta anche quando presente a bassissima concentrazione; di fatto basta la presenza di una sola copia del microorganismo per avere un esito positivo del test.
La “digital” rappresenta un’evoluzione delle già note e consolidate tecniche PCR e “Realtime PCR”; da quest’ultima, infatti, riprende la chimica fluorescente. L’elemento di grande innovazione introdotto dal sistema digital va ricercato nella fase di emulsione, in apposito olio, della miscela di reazione PCR (reagenti per amplificazione e DNA/RNA della pianta oggetto di saggio) che viene in tal modo ripartita in oltre 20.000 goccioline (“droplets”) contenenti ciascuna tutti gli elementi per lo svolgimento di una reazione di amplificazione. Se il campione non è infetto dallo specifico patogeno, nessuna delle goccioline conterrà il DNA/RNA del patogeno e non vi sarà quindi emissione di fluorescenza in nessuna di esse; al contrario, se il campione è infetto dallo specifico patogeno, una parte o tutte le “droplets” emetteranno fluorescenza. La quantificazione del numero esatto di goccioline fluorescenti viene effettuata mediante lettura al “droplet reader” che fornisce una quantificazione precisa del numero di copie del patogeno eventualmente presente nel campione vegetale di partenza.
Questa tecnica è stata recentemente introdotta nei laboratori del CAV e del Distal dell’Università di Bologna (Fig. 1), che hanno collaborato alla messa a punto dei protocolli per la diagnosi di diffuse malattie delle drupacee e della vite: virus della Sharka (PPV), viroide del Mosaico Latente del pesco (PLMVd), fitoplasma delle drupacee (ESFYP) e virus del Pinot Grigio (GPGV). Si tratta di un inizio di sperimentazione, mentre le applicazioni verranno estese nel tempo anche ad altre malattie.
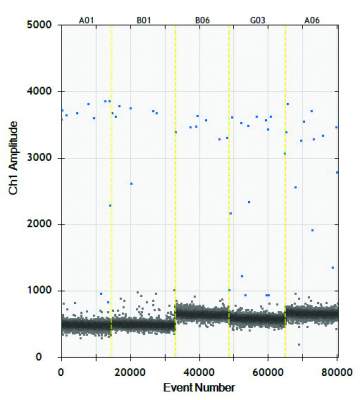
La messa a punto
Come già accennato, la tecnica “digital” sfrutta le chimiche fluorescenti (“primers” e sonde specifiche) della più consolidata “Realtime PCR”, perciò la prima fase della messa a punto del saggio consiste nell’individuazione del protocollo Realtime più idoneo ad essere trasferito in digital. Per protocollo più idoneo si intende quello a più elevate sensibilità e specificità e più largamente validato mediante i principali circuiti inter-laboratorio in ambito nazionale e internazionale.
Non secondaria è stata poi la scelta dei campioni su cui eseguire i test di messa a punto; sono stati impiegati diversi campioni sicuramente malati (controlli positivi) e altri sicuramente sani (controlli negativi, solitamente rappresentati da piante ottenute da seme). Abbiamo lavorato su alcune specie ospiti: susino, albicocco, pesco e vite.
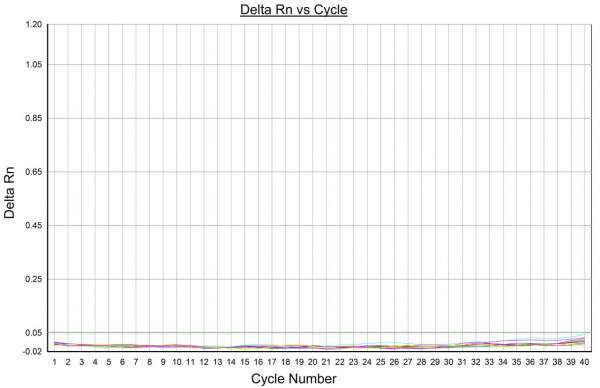
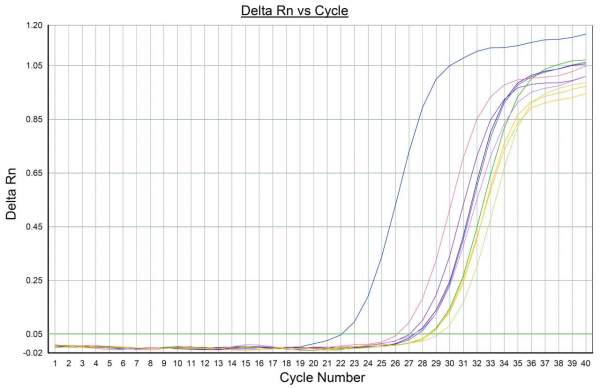
Da questi campioni sono stati estratti gli acidi nucleici (RNA e/o DNA), poi sottoposti in parallelo ai test Real-Time PCR e Digital Droplet PCR (Figg. 2-3). Le condizioni del saggio digital sono state ricavate empiricamente a partire dalle medesime impiegate per l’analisi in Realtime adattando, se necessario, la concentrazione dei reagenti al fine di ottenere un dato finale il più chiaro e univoco possibile. Stabilite le condizioni per eseguire le analisi in digital per ciascun patogeno, si è passati a valutare la bontà dei protocolli messi a punto, in termini di ripetibilità e sensibilità. La prima è stata valutata analizzando in doppio i medesimi campioni presso i due laboratori, CAV e Distal, mentre la sensibilità dei test è stata valutata sottoponendo a diluizioni seriali campioni infetti da ciascun patogeno al fine di individuarne il limite di rilevamento.
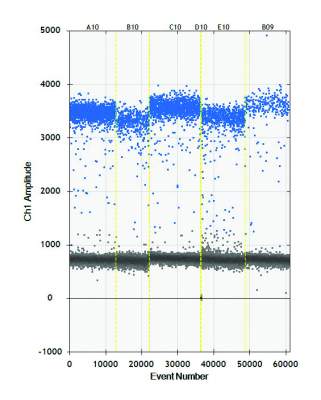
Ambiti applicativi
Le fonti candidate a entrare nel “Sistema nazionale volontario di qualificazione del materiale di propagazione vegetale” (DM 19 marzo 2019) vengono conservate in ambiente totalmente isolato dall’esterno (“pre–screen”) fino al termine dei controlli fitosanitari (Fig. 4). Le metodologie diagnostiche indicate nei disciplinari di certificazione comprendono al momento i saggi biologici su indicatori arborei e/o erbacei (indexaggio), i saggi sierologici (Elisa) e, infine, i test molecolari (PCR e Realtime PCR).
Chiaramente, nessuno di questi saggi raggiunge la sensibilità della Digital Droplet PCR. La nostra intenzione è dunque quella di applicare anche questa tecnica sulle fonti candidate, in particolare per rilevare quei patogeni che possono essere presenti allo stato latente nelle piante, ovvero a concentrazioni bassissime. L’auspicio è che in futuro anche la digital venga inserita nei disciplinari di certificazione vivaistica.
Queste tecniche di diagnostica assoluta potranno essere utilissime per contrastare la diffusione delle malattie nei frutteti. A tal riguardo è stata condotta una sperimentazione in un frutteto di pesco, varietà Zee Lady, nel quale erano presenti alcune piante con sintomi evidenti di mosaico latente (Fig. 5). Sono state campionate foglie provenienti dalle piante con sintomi e dalle piante limitrofe asintomatiche, entrambe sottoposte ai test PCR Real Time e Digital Droplet PCR.
Le analisi hanno chiaramente confermato la presenza del viroide nelle piante sintomatiche, come atteso, ma anche su alcune piante visivamente senza sintomi. Queste ultime piante, cosiddette “serbatoio”, dovranno essere estirpate in quanto favoriscono la diffusione della malattia nel frutteto essendo dimostrato che la principale modalità di trasmissione del viroide da una pianta malata a una sana nei frutteti commerciali è quella dei tagli da potatura.

I test su pesco, susino e albicocco
Da oltre 15 anni, a Cesena, in un’apposita “struttura confinata” (serra chiusa da reti anti-insetto), sono attivi programmi di sperimentazione per la valutazione della sensibilità/tolleranza/resistenza al virus della Sharka (PPV – “Plum Pox Virus”) di varietà di pesco, susino e albicocco, finanziati dalla Regione Emilia-Romagna ad ASTRA-CRPV (Fig. 6). Sono state individuate diverse varietà e selezioni di albicocco che, infettate artificialmente con PPV, non hanno manifestato sintomi specifici di questo virus, né risultanze positive per la presenza dello stesso, quando analizzati con le correnti diagnostiche, cioè metodi sierologici (Elisa) e molecolari (RT-PCR).
Nel contempo, i ricercatori impegnati nel progetto di breeding “Maspes”, che prevede l’impiego di marcatori molecolari a supporto dei programmi di miglioramento genetico, hanno confermato la presenza, in alcune delle varietà che dalla sperimentazione sopra descritta risultavano almeno parzialmente resistenti, di 2 geni associabili alla resistenza a PPV. Si è perciò ritenuto necessario confermare il comportamento di queste varietà e selezioni di albicocco, applicando la tecnica diagnostica molecolare ad oggi ritenuta fra le più sensibili, cioè la ddPCR.
In particolare, con la nuova metodologia si è potuto verificare, nelle piante inoculate con PPV, appartenenti a varietà sensibili e a varietà ritenute resistenti, sia la presenza del virus immesso attraverso l’inoculo artificiale, sia la sua capacità di moltiplicarsi nell’ospite.
I risultati ottenuti hanno confermato che nelle varietà e selezioni che risultavano resistenti il sistema diagnostico ddPCR rileva un numero molto basso, di appena qualche decina di copie, del virus. Nelle varietà suscettibili a Sharka questo sistema rileva un numero altissimo di copie virali, fino ad alcune decine di migliaia.